 У пациентов с унаследованной формой рака толстой кишки имеютс два бактериальных вида, которые ,"сотрудничая",способствут развитию болезни, и те же самые виды были обнаружены у людей, которые развивают спорадическую форму рака толстой кишки - по результатам исследования, проведеннго Институтом Джонса Хопкинса Блумберга-Киммеля для исследовательской группы по борьбе с раком. Второе исследование ,проведенное на мышах, опубликованное одновременно с теми же исследователями, показывает возможный механизм, по которому один из этих видов стимулирует определенный тип иммунного ответа, способствуя - вместо ингибирования - образование злокачественных опухолей. Вместе эти результаты могут привести к новым способам более эффективного скрининга и, в конечном счете, к предотвращению и более ффективному лечению рака толстой кишки, болезни, которая ежегодно убивает более 50 000 человек в США и растет среди молодых людей в возрасте от 20 до 50 лет.
У пациентов с унаследованной формой рака толстой кишки имеютс два бактериальных вида, которые ,"сотрудничая",способствут развитию болезни, и те же самые виды были обнаружены у людей, которые развивают спорадическую форму рака толстой кишки - по результатам исследования, проведеннго Институтом Джонса Хопкинса Блумберга-Киммеля для исследовательской группы по борьбе с раком. Второе исследование ,проведенное на мышах, опубликованное одновременно с теми же исследователями, показывает возможный механизм, по которому один из этих видов стимулирует определенный тип иммунного ответа, способствуя - вместо ингибирования - образование злокачественных опухолей. Вместе эти результаты могут привести к новым способам более эффективного скрининга и, в конечном счете, к предотвращению и более ффективному лечению рака толстой кишки, болезни, которая ежегодно убивает более 50 000 человек в США и растет среди молодых людей в возрасте от 20 до 50 лет.
Для получения информации о том ,как проходит современное лечение рака толстой кишки в Израиле у лучших онкологов страны , оставьте заявку и мы свяжемя с Вами в ближайшеее время !
Дополнительные выводы были опубликованы 1 февраля в Cell Host & Microbe и в выпуске Science за 2 февраля.
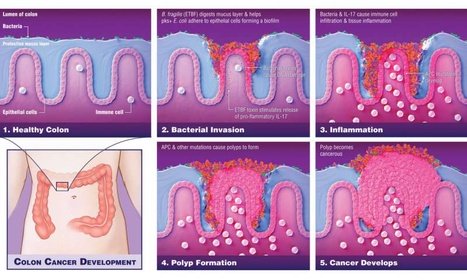
Находки в науке описывают процесс, в котором эти бактерии вторгаются в защитный слизистый слой толстой кишки и сгущают, чтобы создать микроокружение, дополненное питательными веществами и все, что нужно бактериям для выживания, - которое вызывает хроническое воспаление и последующее повреждение ДНК, которое поддерживает образование опухоли. Эти данные свидетельствуют об изменении стандарта ухода за людьми, которые несут оба типа бактерий. «Следует проходить более частую диагностику рака толстой кишки, чем рекомендуется в настоящее время - раз в 10 лет», - говорит Дрю Пардолл, доктор философии, директор Института иммунной терапии им. Блумберга-Киммеля.
Эти новые данные Синтии Сирс, доктора медицины, профессора медицины и исследователя в Институте им. Блумберга-Киммеля в Институте им. Джона Хопкинса Киммеля, основаны на ее ранних исследованиях, в которых показано, что определенные штаммы бактерий могут вторгаться в слизь слизистой, по крайней мере, в половине случаев пациентов, которые развиват рак толстой кишки, но у которых нет наследственной предрасположенности к этой болезни. В отличие от большинства бактерий, которые не проникают через защитный слизистый слой толстой кишки, эти сообщества бактерий, которые вторгаются в слизь, образуют липкую биопленку рядом с эпителиальными клетками толстой кишки, которые выстилают толстую кишку, где обычно развиваетс рак толстой кишки. Там, Сирс и его коллеги предлагают, эти бактериальные сообщества могут в конечном итоге "помочь" эпителиальным клеткам стать раковыми.
Около 5 процентов случаев рака толстой кишки вызваны наследственным синдромом, называемым семейным аденоматозным полипозом (ФАП), в котором унаследованная мутация запускает ряд генетических изменений, которые со временем развиваются и в конечном итоге побуждают клетки эпителия превращаться в злокачественные. Однако, говорит Сирс, неясно, играет ли ETBF или другие бактерии в развитии рака толстой кишки у пациентов с ФАП.
Чтобы исследовать взаимосвязь между бактериальными биопленками и образованием рака, она и ее коллеги исследовали ткань толстой кишки, удаленную от шести пациентов с ФАП. Испытания показали наличие пятнистых участков биопленок, распределенных вдоль толстой кишки у около 70 процентов пациентов. Исследователи использовали гены-зонды для идентификации конкретных видов бактерий и обнаружили, что биопленки состоят в основном из двух типов: Bacteroides fragilis и Escherichia coli, что является неожиданным результатом, поскольку толстая кишка содержит по меньшей мере 500 различных типов бактерий. Тесты на 25 дополнительных образцах толстой кишки у пациентов с ФАП показали, что штамм B. fragilis является подтипом, называемым ETBF, который вырабатывает токсин, который вызывает определенные онкогенные или раковые пути в клетках кишечника и вызывает воспаление толстой кишки. Штамм E. coli продуцировал вещество, называемое колибактином (синтезированное набором генов в бактериальном геноме, называемом островом PKS), что вызывает мутации ДНК. «Это сочетание этих эффектов, требующих сосуществования этих двух бактерий, создает« идеальный шторм »для развития рака толстой кишки, - говорит Сирс. Обнаружено, что оба типа бактерий обычно колонизируют маленьких детей во всем мире, что потенциально способствует росту показателей рака толстой кишки среди молодых людей.
«ФАП - это разрушительная болезнь, которая в конечном итоге приводит к хирургическому удалению толстой кишки, и наши результаты могут указывать на новые и менее инвазивные способы предотвращения развития и леение рака толстой кишки», - говорит Сирс. Она говорит, что эти же подходы могут быть применены к более распространенным спорадическим типам рака толстой кишки, которые происходят без семейной предрасположенности. В настоящее время колоноскопия для наблюдения за образованием предраковых опухолей, называемых полипами, является стандартом . Если дальнейшие исследования показывают, что биопленки развиваются до появления полипов, Сирс говорит, добавив, что оценка биопленки или идентификация табулатуры конкретных бактерий для ухода может также предоставить возможность для более раннего, нехирургического лечения , которое могло бы удалить бактерии из толстой кишки.
Используя мышечную модель рака толстой кишки, исследователи обнаружили, что животные, у которые были колонизированы только одним из этих видов, развивали мало или вообще не имели опухолей. Однако, когда они были колонизированы обоими видами одновременно, у них появилось много опухолей, что свидетельствует о синергии между двумя типами бактерий.
Более раннее исследование 2009 года, опубликованное лабораторией Sears в Nature Medicine, показало, что уникальный тип иммунного ответа - продуцирующий воспалительный белок под названием IL-17 - является ключом к формированию опухоли, индуцированной ETBF. Пардолл и Сирс говорят, что важно отметить, что этот тип иммунного ответа отличается от антагонистических типов противоопухолевых иммунных реакций, вызванных терапевтическими иммунотерапевтическими препаратами.
Чтобы доказать важность ИЛ-17 в противораковых эффектах бактериальной комбинации, они использовали модель мыши, в которой ген IL-17 был генетически удален, поэтому он не мог сделать ИЛ-17 и колонизировал мышей с помощью как ETBF, так и PKS + E. палочка. В отличие от животных, которые легко получали ИЛ-17, генетически измененные мыши не образовывали опухоли толстой кишки, подтверждая важность этого белка в бактериальном раке толстой кишки. Однако в дополнение к IL-17 исследования показали, что ETBF переваривает слизистый слой, позволяя PKS + E. coli прилипать в большем количестве к слизистой оболочке толстой кишки, где вместе бактерии индуцировали увеличение повреждения ДНК, шаг, предшествующий мутациям генов, которые лежат в основе образования опухоли толстой кишки.
Дополнительные результаты в Cell Host & Microbe показывают, как токсин ETBF подсказывает развитие рака толстой кишки. Используя другую модель мышиного рака толстой кишки, исследователи колонизировали животных с помощью ETBF, а затем провели серию тестов для мониторинга полученных клеточных и молекулярных изменений.
Их результаты показали, что токсин ETBF стимулирует каскад событий, которые способствуют воспалению толстой кишки, которые питаются обратно, чтобы действовать на клетки эпителия толстой кишки. Во-первых, токсин вызывает иммунные клетки толстой кишки для продуцирования IL-17. Эта воспалительная молекула затем воздействует непосредственно на эпителиальные клетки толстой кишки, чтобы инициировать активацию белкового комплекса, участвующего в дальнейшем воспалении, известном как NFkappaB. NFkappaB, в свою очередь, индуцирует эпителиальные клетки толстой кишки для продуцирования нескольких сигнальных молекул, которые набирают больше иммунных клеток, называемых миелоидными клетками, в толстую кишку. Эти иммунные клетки участвуют в воспалительном ответе и, как известно, поддерживают рост опухоли. Этот процесс завершается образованием рака толстой кишки. Дополнительные эксперименты показали, что для образования опухоли также необходим белок, известный как STAT3, который ранее был показан как играющий роль в регуляции рака и воспалительных генов.
Вместе Сирс говорит, что два новых исследования предполагают различные стратегии, которые исследователи могут тестировать для предотвращения или даже лечения рака толстой кишки. Например, может быть возможно предотвратить это заболевание, если кишеник не будет колонизирован этими двумя проблемными бактериями или путем разработки лекарств или вакцин, нацеленных на их токсины. Исследователи, возможно, в конечном итоге смогут остановить злокачественный каскад, нацелив одного или нескольких разных молекулярных игроков, которые увеличивают воспаление в толстой кишке. Исследователи также работают над тем, чтобы лучше понять, почему иммунная система позволяет продолжать воспаление.



Комментарии
Пока комментариев нет
Новый комментарий